Drug-Induced Acute Kidney Injury Clin J Am Soc Nephrol. 2022 ;17:1220.
薬剤性腎障害のレビューになります。量が多いので病態生理で分けて3回の投稿にします。
初回は急性尿細管障害です。薬剤性腎障害とはよく言いますが、それがどんな機序の障害なのかまでは恥ずかしながらあまり考えずに薬剤中止して回復まで祈ることが多かったです。
障害の具体的な病態としては尿細管障害とミトコンドリアのアポトーシス誘導、リソソーム障害になるのですね。ここまで意識することですぐに具体的なマネジメントが変わるわけではないですが、参考になれば幸いです。
NotebookLMを用いて内容をまとめ、chatGPTで「上記文章に書かれていいないことは許可しない限り出力するな」と伝えたのちに文章を修正しています。ハルシネーション対策で内容も確認していますが、気になる方は申し訳ないですがご自身でもご確認ください。
薬剤性急性尿細管障害(ATI, Acute Tubular Injury)とは?
特定の薬剤による直接的な尿細管細胞の損傷が原因で生じる急性腎障害(AKI)の一形態。特に近位尿細管が影響を受ける。
1. 病態機序
薬剤性ATIは以下のようなメカニズムで発症する。
(1) 直接的な尿細管毒性
- 一部の薬剤は尿細管細胞に直接毒性を示し、アポトーシス(細胞死)や壊死を引き起こす。
- 特に近位尿細管は、薬剤の排泄経路であるため影響を受けやすい。
(2) 血行動態の変化
- 腎血流の低下により、腎組織が虚血状態に陥る。
- これにより、酸素や栄養供給が不十分となり、尿細管細胞が障害を受ける。
(3) 重要なリスク因子
- 基礎疾患(慢性腎臓病、糖尿病、高血圧など)
- 高齢者
- 循環血液量減少(脱水、出血、低アルブミン血症など)
- 複数の腎毒性薬剤の併用
2. 原因薬剤と発生率
| 薬剤名 | AKI発生率 | 主なメカニズム |
|---|---|---|
| テノホビル・シドホビル | 12~24% | 近位尿細管のミトコンドリア障害 |
| アミノグリコシド | 10~25% | リソソーム蓄積・ミトコンドリア損傷 |
| バンコマイシン | 0~20%以上 | 腎血流低下・酸化ストレス |
| シスプラチン | 2~50% | 直接的な尿細管毒性・DNA損傷 |
3. 主要な薬剤の作用機序
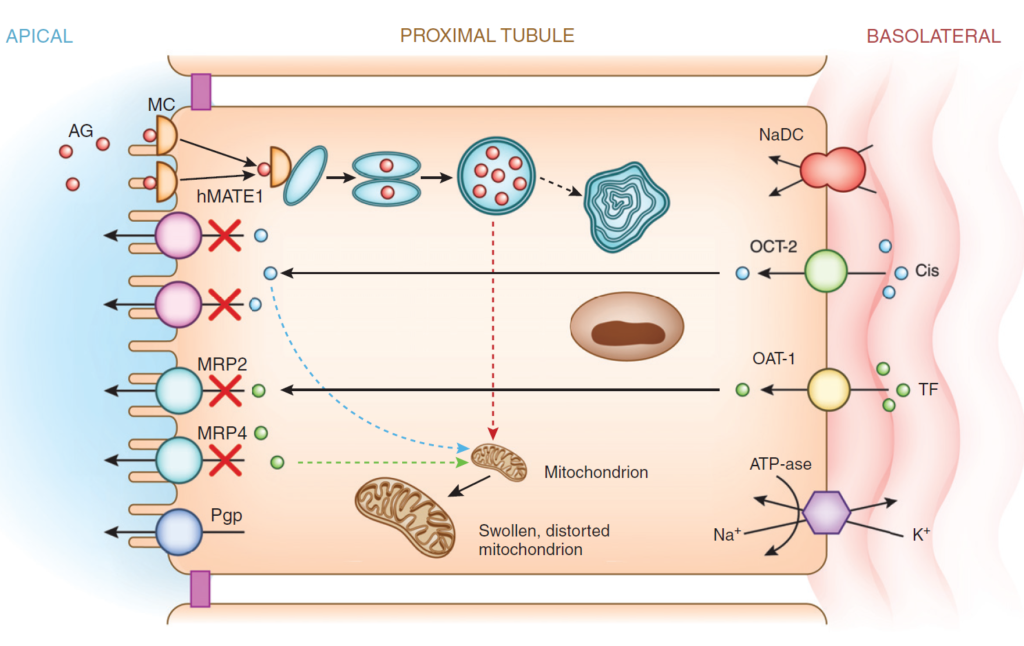
【略語】•AG: アミノグリコシド •Cis: シスプラチン •TF: テノホビル
•hMATE1: ヒト多剤および毒素排出タンパク質トランスポーター1
•OAT1: ヒト有機アニオントランスポーター1 •OCT2: ヒト有機カチオントランスポーター2
•MC: メガーリン-キュビリン •MRP: 多剤耐性タンパク質トランスポーター
•NaDC: ナトリウムジカルボン酸トランスポーター •Pgp: P-糖タンパク質トランスポーター
アミノグリコシド(AG, 赤色)
- 細胞表面での相互作用
- 多価カチオン性のアミノグリコシドはアニオン性リン脂質膜に引き寄せられる。
- **メガーリン-キュビリン受容体(MC)**を介して細胞に取り込まれる。
- 細胞内移行と毒性
- エンドサイトーシスにより細胞内に入り、リソソームへ輸送される。
- リソソーム損傷とミエロイド体の形成が起こる。
- ミトコンドリア損傷を伴い、尿細管細胞のアポトーシスおよび壊死を引き起こす。
シスプラチン(Cis, 青)
- 細胞への取り込み
- **基底膜からhOCT2(ヒト有機カチオントランスポーター2)**を介して細胞内に輸送される。
- 細胞外への排出と蓄積
- **hMATE1(ヒト多剤および毒素排出タンパク質1)**などの頂端輸送体を介して尿腔へ排出される。
- しかし、hMATE1の排出が不十分、またはhOCT2を介した取り込みが過剰になると、細胞内にシスプラチンが蓄積する。
- 細胞毒性
- **TNF-α、TGF-β、活性酸素種(ROS)**の産生を促進し、尿細管損傷を引き起こす。
- ミトコンドリア毒性を引き起こし、アポトーシスを促進する。
テノホビル(TF, 緑)
- 細胞への取り込み
- **基底膜からhOAT1(ヒト有機アニオントランスポーター1)**を介して細胞内に輸送される。
- 細胞外への排出と蓄積
- **MRP2およびMRP4(多剤耐性タンパク質トランスポーター)**を介して尿腔内に排出される。
- MRP輸送機能が低下すると、細胞内にテノホビルが蓄積する。
- 細胞毒性
- ミトコンドリアDNA合成を低下させ、ミトコンドリア機能を障害する。
- ミトコンドリア毒性により尿細管損傷を引き起こす。
4. 臨床症状
- 治療開始後5~7日で非乏尿性AKIを発症。
- 多尿や低マグネシウム血症を伴うことが多い。
- 薬剤中止で腎機能が回復するが、長期使用では慢性腎障害を残す場合がある。
5. 予防戦略
| 薬剤 | 予防策 |
|---|---|
| アミノグリコシド | 1日1回投与、eGFRに基づいた用量調整、トブラマイシンの使用推奨 |
| バンコマイシン | eGFRに基づいた用量調整、トラフ濃度15ng/ml未満、ピペラシリン-タゾバクタム併用回避 |
| アムホテリシンB | リポソーム製剤の使用、生理食塩水による静脈内輸液 |
| シドホビル・テノホビル・アデホビル | eGFRに基づいた用量調整、尿細管毒性スクリーニング、代替薬の使用 |
| シスプラチン | eGFRに基づいた用量調整、生理食塩水輸液、低用量レジメン、チオ硫酸ナトリウムの考慮 |
6. 治療
- 原因薬剤の中止が最優先。
- 静脈内輸液による腎灌流の維持。
- 腎毒性物質の回避(NSAIDs、ループ利尿薬など)。
- 高感度バイオマーカーを用いた早期診断が今後の課題。
